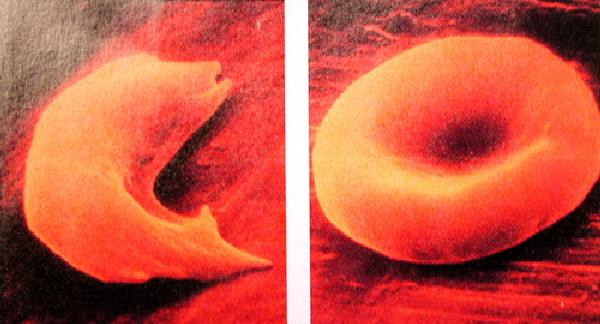
Eine Sichelzellkrise besteht nicht nur daraus, dass sichelförmige rote Blutkörperchen Kapillaren verstopfen. Eine zweite, noch klebrigere Art von roten Blutkörperchen löst die Blockade aus, indem sie es für die Sichelzellen schwer machen, an ihnen vorbeizufließen.
Durch die Verwendung leistungsfähiger Computermodelle konnten Forscher der Brown University in Providence (Rhode Island, USA) erstmals aufzeigen, wie unterschiedliche Typen von roten Blutkörperchen interagieren, um die sogenannte Sichelzellkrise zu verursachen. Dabei handelt es sich um eine gefährliche Blockade des Blutflusses in den Kapillaren, welche reißende Schmerzen und Gewebeschäden bei Menschen verursacht, die an Sichelzellenanämie leiden.
Die Modelle zeigten, dass die unnachgiebigen, sichelförmigen roten Blutkörperchen, die das Erkennungszeichen der Sichelzellanämie sind, diese Blockaden nicht alleine auslösen. Stattdessen lösen weichere, verformbare rote Blutkörperchen (SS2-Zellen genannt) den Vorgang aus, indem sie sich an die Wände der Kapillaren heften. Die starren, sichelförmigen Zellen stauen sich dann hinter den SS2-Zellen auf, so wie der Verkehr hinter einem verunfallten Auto.
Die Ergebnisse, veröffentlicht in den Proceedings of the National Academy of Sciences, könnten einen Weg zur Entwicklung von Medikamententherapien aufzeigen, die darauf abzielen, Sichelzellkrisen, die man im Englischen auch „vaso-occlusive [gefäßverschließend] crisis“ nennt, zu lindern oder zu verhindern.
Video-Link: https://youtu.be/IYtCmAGyg3k
Diese Animation zeigt die relative Klebrigkeit von SS2-Zellen und Sichelzellen. (Karniadakis lab / Brown University)
„Dies ist die erste Studie, die einen spezifischen biophysikalischen Mechanismus identifiziert, durch den die Gefäßverschlüsse ausgelöst werden“, sagte George Karniadakis, Professor für angewandte Mathematik an der Brown University und leitender Autor der Studie. „Das war ein überraschendes Ergebnis, denn der gängige Wissensstand war, dass nur die Sichelzellen alleine die Kapillaren blockieren.“
Sichelzellenanämie ist eine genetische Erkrankung, die ungefähr 75.000 bis 100.000 Menschen in den Vereinigten Staaten betrifft, die meisten davon afrikanischer oder spanischer Herkunft. Abnormales Hämoglobin – das Protein, das die roten Blutkörperchen dazu befähigt, Sauerstoff zu transportieren – lässt die Sichelzellen ihre halbmondförmige Gestalt annehmen und unelastisch werden. Diese verlängerte Form und die Unfähigkeit nachzugeben hielt man für den Grund dafür, dass Sichelzellen Blockaden in den Kapillaren verursachen.
Aber auch wenn die sichelförmigen Zellen das Erkennungszeichen dieser Erkrankung sind, so sind sie doch nicht die einzigen Typen roter Blutkörperchen, die bei Menschen mit dieser Krankheit auftreten. Forschungen in den 1980er Jahren ergaben, dass es sogar vier Typen von roten Blutkörperchen bei der Sichelzellenanämie gibt, und nicht alle davon sind starr und sichelförmig. Ein Zelltyp, die SS2-Zelle, behält ihre runde Form und die weiche Geschmeidigkeit normaler roter Blutkörperchen.
„Sie sehen aus wie gesunde Zellen“, so Karniadakis, „aber sie sind klebrig.“ Die SS2-Zellen besitzen auf ihrer Zellmembran Rezeptoren, die sie an den Wänden von Blutgefäßen haften lassen. Sichelförmige Zellen besitzen dieselben klebrigen Proteine, doch Karniadakis Modell zeigte, dass die SS2-Zellen viel wahrscheinlicher steckenbleiben. „Weil die SS2-Zellen verformbar sind, haben sie auch eine größere Kontaktfläche mit der Gefäßwand, deswegen kleben sie eher fest“, sagte Karniadakis. Sobald diese Zellen einmal feststecken, verringern sie den Durchmesser des Gefäßes erheblich und verursachen hinter sich einen Stau der sichelförmigen Zellen.
Video-Link: https://youtu.be/w7j3n2Xba6Q
Diese Animation zeigt die Bildung einer Blockade durch SS2-Zellen. (Karniadakis lab / Brown University)
Diese Modelle, die auf experimentell erhaltenen Daten realer Zellen basieren, gestatten es den Wissenschaftlern, die Charakteristika der Zellen zu manipulieren, um zu sehen, welche davon die Blutblockaden verursachen. Wenn die Forscher zum Beispiel die Klebrigkeit oder Elastizität der SS2-Zellen verringern, bilden sich keine Blockaden. Ebenso fließt das Blut weiter, wenn sie die Starrheit der sichelförmigen Zellen heruntersetzen. Es sind diese beiden Bedingungen, die zusammenarbeiten und die Blockaden verursachen, aber die SS2-Zellen sind diejenigen, welche die Kaskade auslösen. „Letztendlich spielen die starren Sichelzellen nur eine sekundäre Rolle, weil die Kausalität mit den elastischen Zellen beginnt, die an den Wänden kleben bleiben“, erklärte Karniadakis.
Die Forscher hoffen, dass die Modelle bei der Entwicklung von Medikamenten helfen können, die darauf abzielen, die Sichelzellkrise zu behandeln. „Wenn ein Medikament versucht, die Hafteigenschaften einer Zelle zu verändern oder die Flexibilität einer Zelle zu erhöhen, können wir es testen und überprüfen, ob es im Modell die Gefäßverschlüsse verhindert“, sagte Karniadakis.
Erstautor der Studie ist Huan Lei, postdoktoraler Forscher für angewandte Mathematik an der Brown University. Die Studie wurde finanziert von den National Institutes of Health (R01HL094270) und dem neuen Collaboratory on Mathematics for Mesocopic Modeling of Materials (CM4) und unterstützt vom Department of Energy. Die Computer-Berechnungen wurden durch den DOE/Innovative and Novel Computational Impact on Theory and Experiment Award ermöglicht.
Quelle: http://news.brown.edu/pressreleases/2013/06/sicklecell
(SOM)
Antworten