Ein Forschungsteam hat mit der Kernphysik-Einrichtung ISOLDE am CERN erstmals die sogenannte Elektronenaffinität des chemischen Elements Astat gemessen, dem seltensten natürlicherweise auf der Erde vorkommendem Element. Das Ergebnis, beschrieben in einer Studie im Journal Nature Communications, ist wichtig für die Grundlagenforschung und angewandte Wissenschaft. Das Ergebnis bietet einen Zugang zu bislang unbekannten Eigenschaften dieses Elements und erlaubt die Prüfung theoretischer Modelle. Es ist von praktischem Interesse, weil Astat ein vielversprechender Kandidat für die Entwicklung chemischer Bestandteile zur Krebsbehandlung im Rahmen zielgerichteter Alpha-Therapien ist.
Die Elektronenaffinität ist die freigesetzte Energie, wenn sich ein Elektron an ein neutrales Atom in der Gasphase bindet, um ein negatives Ion zu bilden. Sie ist eine der grundlegendsten Eigenschaften eines chemischen Elements. Zusammen mit der Ionisationsenergie (der benötigten Energie zum Herausreißen eines Elektrons aus dem Atom) definiert sie mehrere andere Merkmale eines Elements. Dazu gehört beispielsweise seine Elektronennegativität – die Fähigkeit des Elements, geteilte Elektronen in chemischen Bindungen zwischen Atomen anzuziehen.
Obwohl Astat in den 1940er Jahren entdeckt wurde, stützte sich das Wissen über seine Eigenschaften hauptsächlich auf theoretische Berechnungen oder Extrapolationen aus den Eigenschaften seiner verwandten Elemente im Periodensystem: Astat ist ein Mitglied der Halogene, zu denen auch Chlor und Jod gehören. Der Grund dafür ist die Seltenheit von Astat auf der Erde. Die winzigen Mengen des Elements, die im Labor produziert werden können, verhindern den Gebrauch traditioneller Techniken, um dessen Eigenschaften zu messen. Eine bemerkenswerte Ausnahme war eine frühere Messung der Ionisationsenergie des Elements an der ISOLDE-Einrichtung.
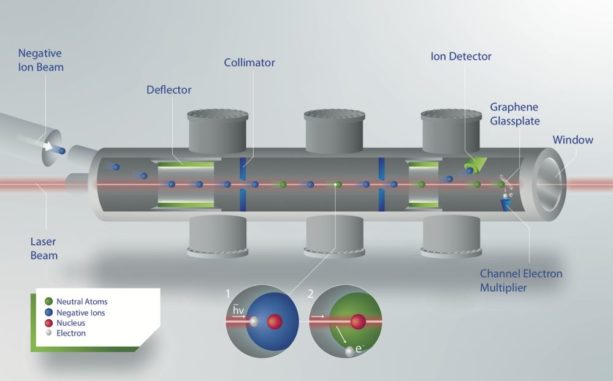
In der neuen ISOLDE-Studie wurden Astat-Atome zunächst gemeinsam mit anderen Atomen produziert, indem ein hochenergetischer Strahl aus Protonen aus dem Proton Synchrotron Booster auf ein Thorium-Ziel geschossen wurde. Die Astat-Atome wurden dann negativ ionisiert, und die Ionen des Isotops 211At wurden extrahiert und in ein spezielles Messinstrument transportiert. In dem Instrument wurde Laserlicht einer einstellbaren Energie auf die Ionen geworfen, um die Energie zu messen, die für das Herausziehen des zusätzlichen Elektrons aus dem 211At-Ion erforderlich ist, wodurch das Ion wieder zu einem neutralen Atom wird.
Aus dieser Messung erhielt das Team einen Wert von 2,41578 Elektronenvolt für die Elektronenaffinität von Astat. Dieser Wert stimmt mit dem Wert überein, den die Autoren anhand moderner theoretischer Berechnungen ableiteten, und spricht dafür, dass die Elektronenaffinität von Astat die geringste aller Halogene ist. Dennoch ist sie größer als die jedes anderen bislang gemessenen Elements außerhalb der Halogene.
Die Forscher nutzten die abgeleitete Elektronenaffinität und die frühere Messung der Ionisationsenergie, um verschiedene andere Eigenschaften von Astat zu bestimmen, beispielsweise seine Elektronennegativität.
Diese Eigenschaften sind relevant für Untersuchungen zur möglichen Verwendung von 211At in Bestandteilen bei der zielgerichteten Alpha-Therapie. Dabei werden Krebszellen mit Alpha-Strahlung behandelt. Astat ist eine ideale Quelle der Alpha-Strahlung, aber die meisten der untersuchten 211At-Verbindungen leiden an der schnellen Freisetzung von negativen 211At-Ionen, was gesunde Zellen beschädigen könnte, bevor diese Verbindungen die Krebszellen erreichen.
„Unsere Ergebnisse können verwendet werden, um unser Wissen über diese Freisetzungsreaktion und die Stabilität der 211At-Verbindungen zu verbessern, die für die zielgerichtete Alpha-Therapie in Betracht gezogen werden“, sagte David Leimbach, der Hauptautor der Studie. „Darüber hinaus ebnen unsere Ergebnisse den Weg zu Messungen der Elektronenaffinität von Elementen, die schwerer als Astat sind, möglicherweise von superschweren Elementen.“
„Mit dem aktuellen Ergebnis beenden wir ein zehn Jahre dauerndes ISOLDE-Projekt, um die grundlegenden Eigenschaften von Astat zu bestimmen, die Ionisationsenergie und die Elektronenaffinität, was uns endlich erlaubte, die Elektronennegativität von Astat abzuleiten“, sagte Sebastian Rothe, der Hauptautor der früheren Studie.
(THK)
Antworten